简介
仿制药则是在原研药专利到期后,其他制药企业复制其主要分子结构生产出来的药物。这些药物在活性成分、给药途径、剂型和规格等方面与原研药相同,但制备工艺、辅料和包装材料等方面可能存在差异。由于省去了大量研发成本,仿制药的价格通常远低于原研药。
分析
仿制药利弊
:::: tabs top-start
::: tab-pane 优势
价格亲民
仿制药的研发成本低,因此价格相对较低,能够显著提高患者对药品的可获得性。
活性成分相同
仿制药保留了原研药的主要活性成分,因此具有相同的治疗作用。
例如,乙肝病毒几乎无法被杀死,患者一般需要持续用药,国产的恩替卡韦分散片为仿制药,其价格相对来说有优势,使得更多乙肝患者能够负担得起治疗费用,成为众多患者的首选药物。
:::
::: tab-pane 劣势
疗效和安全性可能略逊
虽然仿制药的活性成分与原研药相同,但由于制备工艺、辅料等方面的差异,其疗效和安全性可能略逊于原研药。例如,北京大学人民医院的研究显示,国产仿制的比索洛尔在降压效果上略逊于进口原研药。
辅料差异
辅料是药物起效的关键因素之一,不同企业生产的辅料可能存在差异,影响药物的稳定性和不良反应。
:::
::::
疗效
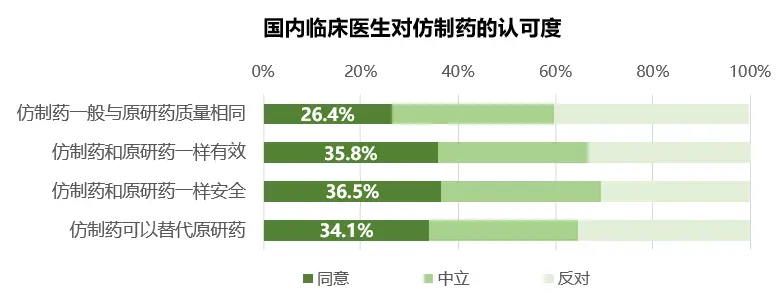
调查结果与个体微观感知的温差,主要在于集采仿制药“一致性评价”的差异。
所谓一致性评价,在我国,主要看药学等效性和生物等效性,当试验制剂和参比制剂的药动学参数的几何均值比值位为80%—125%时,即可认为生物等效。
:::: collapse-panel accordion
::: collapse-item 药学等效性
药学等效性是指相同剂型的药品含有等量的活性成分并符合同样的质量标准或其他适用标准。
相同的活性成分
相同的剂型——片剂、胶囊、混悬剂等
相同的给药途径——口服、注射、给药、局部给药等
同样的剂量、规格或浓度——100mg、10mg/mL等
相同的质量——含量、纯度、均一性、稳定性等
:::
::: collapse-item 生物等效性
生物等效性是指在相似的试验条件下单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内。并且这个速度和程度在试验中要是稳定、可复刻的。
主要以药动学参数为终点评价指标:通常采用药代动力学终点指标最大血药浓度Cmax和药物浓度-时间曲线下面积AUC进行评价。[^人体生物等效性]
[^人体生物等效性]:以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则 · 辽宁省检验检测认证中心 · 2016年03月19日
:::
::::
过去,这样的做法确实是国际的“金标准”,但是目前而言,则略显滞后。
以大洋彼岸为例,美国食品药品管理局(FDA)于2022 年7 月发布了“治疗等效性评价供企业用指导原则”(草案)。其中规定,评价处方药品治疗等效性的科学和监管基本原则包括:
药学等效性、生物等效性,以及在说明书规定的使用条件下临床疗效和安全性相同。
相较而言,中国的一致性评价主要还是“理论上”一致,而不等于临床效果一致。
此外,与大众认知不同的是,原研药企最大的“护城河”,实际并不是药品成分,而是辅料、生产工艺,而这些内容药企不必公开。
所以仿制药即便做到与原研药成分一致,但是因为添加的辅料不同,也可能出现药物体内溶解性、生物利用度与稳定性、乃至疗效的不同,尤其是一些小剂量的药品。
仿制药需要研究被仿药的剂型,结合药物理化性质和生物学性质,确定生产工艺的关键步骤和关键工艺参数,因为工艺过程有很多影响制剂质量的环节,比如普通片剂的粉碎、混合、干燥、压片过程都会对片剂质量产生影响,如果制剂工艺控制不足,会影响药品质量稳定。
如果仿制药无法获得关键的工艺步骤,或者存在被仿药的生产工艺有专利保护,仿制药无法使用的情况,那么仿制药的生产受到影响是无法避免的,并且最终可能会影响到药物疗效和安全性。
工艺水平的差距,也会导致效果不同。最典型的例子就是头孢皮试,在国内,医院普遍要求患者在使用头孢菌素类药物前要做皮试,进口的原研药则不必如此。背后正是因为过去我国的提纯工艺无法严格控制药物的杂质含量。
与此同时,仿制者也可能存在投机、走捷径的行为,而忽视工艺、辅料、流程、晶型、异构等内在影响药物质量因素,难免存在纰漏。 这一点,《仿制药的真相》[^仿制药的真相]这本书有详细的调查记录。
[^仿制药的真相]:《仿制药的真相》 · 凯瑟琳·埃班 · 民主与建设出版社 · 2020年10月
求知
拓展
:::: collapse-panel accordion
::: collapse-item 中国人为什么用不上平价救命药
专利问题
很多分析就将专利壁垒当作问题的关键,搬出印度曾经长期对外国药品专利的不支持,以及对国际「药品专利强制许可」的执行力度。
所谓「药品专利强制许可」,简单来讲,就是当重大公共健康危机发生——比如说传染病、发病率高的重大疾病,而该国又没有能力生产「救命药」时,就可以通过一系列法律框架和谈判,强行取得专利。
但很少有人注意到的是,印度为仿制药提供的法律制度性支持,中国法律制度并非没有提供。
和印度一样,中国也经历过长期没有专利相关法律法规的年代,以及有专利法但几乎没有执行的年代。1985 年第一版专利法根本没有保护药品。直到 1992 年,为了入世谈判,中国出台了一系列过渡性法规。2001 年加入世贸组织后,中国才有了规范的药品专利法规。
「强制许可」也有法规支持。
按理说,中国可以拥有跟印度一样强大的「药品专利强制许可」谈判能力。不过,由于各方利益难以平衡,这项规定在中国《专利法》颁布 30 年以来,一次都没有被实践过。
想要做仿制药,专利甚至可以完全不是问题——最近的十年刚好是仿制药的黄金时间,因为「专利断崖」来了。
药品专利的保护也有一定期限,一般是 6 年。2013-2020 年,全球每年专利到期品种平均超过 200 个,其中不乏明星品种。2014 年,全球有 326 个原研药的专利到期,都可以合法仿制。
因此,中国难以造出廉价的仿制药给患者使用,并不能怪到专利制度头上。虽然中国化学药品批号 95% 以上都给了仿制药,但从品类、疗效到价格,中国的仿制药都奇怪地毫无优势可言。
层层掣肘的中国仿制药行业
在中国做新药难,做仿制药也难。做药难,首先就难在药企能力的不足。
为了说明这一点,首先要从制药的生产流程说起。
制药非一日之功,化工原料要经过一系列复杂的处理,这个过程中的产物叫医药中间体。最终得到的有效成分,称为原料药,也就是药品中的有效成分。有了有效成分,我们还要把它提纯,加入药品辅料,做成真正的胶囊、药片、注射剂。这是需要一整个产业链才能完成的事。
如果你要做一种仿制药,除了把「正版」研究透,还要寻找合适的中间体、原料药,以及药品辅料了。而这些东西,大多数是由全国四千余家中小型药企生产的。
中国大多数原料药和制剂药企都是中小企业,「百强」的市场集中度大概只有 50% 左右,远低于全球范围内的 80% 左右。其中,很多企业连《药品生产质量管理规范》(GMP 质量标准)和环保排污的要求都达不到。
企业规模上不去,获得融资能力和研发能力也上不去。至今中国生产和出口量最大的原料药,还是低端老四样:维生素,食品添加剂、甜味剂,抗生素。这些「大路货」占据产能,同时带来原料药生产利润低下、高端品种依赖进口的问题,形成恶性循环。
药品辅料的问题更是一言难尽。
相比于美国 FDA 要求仿制药的辅料达到和药品相同的标准,中国的药品辅料生产和使用基本上没有规范。虽然早在 2006 年中国就出台过《药用辅料生产质量管理规范》(药辅 GMP 标准),但这个标准是非强制的,疏于管理、无人监督。
别小瞧药品辅料的作用。一颗好的胶囊能够决定一粒药是在口腔、胃里还是肠道里准确地散开,进而直接影响仿制药的药效。一颗糟糕的胶囊则可能来自铬超标的工业明胶。
当原料齐备,你的仿制药终于可以研发制造了。这时候你需要解决的核心难题就来了:怎么确定仿制药和原来的药物效果一样?
仿制药可不是「假药」,做仿制药和开发新药一样,都需要规范的研发、生产、审评。光把药品的「物质」照样造出来还不够,还需要保证「一致性」——药理上一样,对人体的作用也一样。
然而,就在几年前,中国仿制药的一致性评价标准还是一片混乱。
比如,要审评「一致性」,首先得确定用来参照的原版药物是什么,专业名词叫「参比制剂」。要仿制阿莫西林,就得从全世界那么多品牌的阿莫西林里选择一种,才能有标准。
中国报备参比制剂的正式制度长期缺席。即便报备了,也有可能不能获得原研药企业的支持,甚至因为原版药退市完全买不到药。国内还出现过某品种的参比制剂公布太晚,导致 43 家企业集体「抄错对象」的惨案。
因为审评制度和标准上的缺失,长期以来,国产仿制药安全而低效,参比制剂混乱、晶形和剂型随便、辅料业余、疗效无把关,除了肯定含有宣称的成分,其他一切都是不确定的。
好在,2013 年,中国终于出台了仿制药一致性评价制度。溶出曲线已经纳入了评价「药学一致性」的重要指标。虽然技术标准极不完整,但总归是一大进步。
但别以为这就完了,因为后面还有更棘手的「生物等效性」的检验难题。
要审评仿制药的「生物等效性」,就很可能需要通过临床试验这一大难关。
由于相关规定,中国的临床实验只能在获得批准的、数量有限、排期紧缺的「临床试验基地」进行。这些基地大多同时又是三甲医院,仿制药难以搞出科研成果,这些基地的冷淡态度也就可想而知。
在不断的降积压手段之后,我们药品注册申请的积压项目,终于从 2015 年高峰时的近 22000 件,降到了 2016 年底的 8863 件,并在之后的一年中继续下降。
好了,费尽千辛万苦,你的仿制药终于通过了审评。
据估算,一个仿制药要在中国走通这个正规流程,至少需要 500 万到 1000 万人民币——这还不算各级寻租、积压拖延的成本。
由于做药难,中国的仿制药整体上并不便宜。
用上救命药,依然不容易
如前所述,救命药即便在中国成功仿制,也很难人人买得起,一时半会指望不上。不过,中国人还有一根救命稻草:国家药品价格谈判,即由政府出面,向原产药企压低售价。
截至去年,累计谈判成功药物共有 39 种,基本上降价幅度都在「打五折」以上。
不过,国家药品价格谈判的滞后性,使印度仿制药依然具有强大竞争力——现在,国内的患者已经开始从印度、老挝和孟加拉代购副作用更小的「替诺福韦二代」TAF 了,代购价大概只有 400 元一个月。
而且,即便原版药品在国家谈判后降价了,或者有厂家真的生产出了良心价的国产仿制药,你也不一定能用得上。
这是因为,虽然中国的医保药品目录是通用的,由卫生部门确定,但医院采购、使用管理和核算报销政策是分省的,并且涉及到当地人社部门。多数一般药品只能靠药企反复公关,一个省一个省地拿下,或者拿不下。
而且,国家医保药品目录平均五年才更新一次。
虽然形势在逐渐好转,但在未来的几年中,国产平价救命药仍将是可望不可及。中国患者代购印度「假药」的困局,仍将持续下去。
不要忘了,依据检方的不起诉决定书,「药神」的原型陆勇之所以被法律宽恕,首要因素是因为其替病友代购的行为全部是无偿帮助,未收取任何额外费用,因此未被认定为销售行为。
如果病友信赖的代购者不再是陆勇这样完全无偿的完美被告人,所购药品依然被中国法律定义为「假药」,那么代购者仍必然构成刑法上的销售假药罪而身陷囹圄。[^平价仿制药]
[^平价仿制药]:中国人为什么用不上平价救命药 · 大象公会 · 2018年07月05日
:::
::::